Фотофизика ДНК
Современные исследования показывают, что квантовые когерентные эффекты играют определяющую роль в успешном функционировании ряда природных систем [1]. Азотистые основания в спиралях НК (рис.1) так же упорядочены, как и пигменты в фотосинтетических системах.
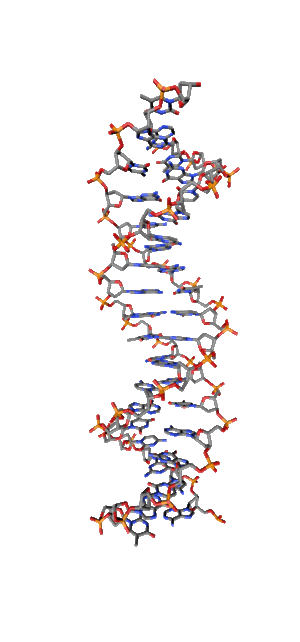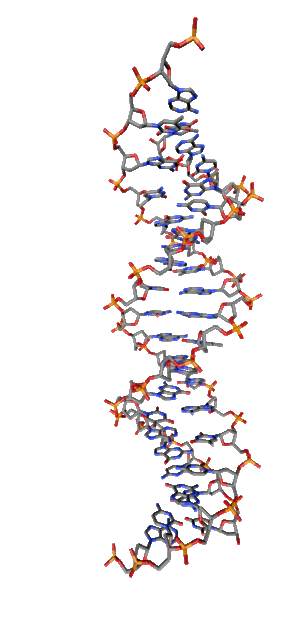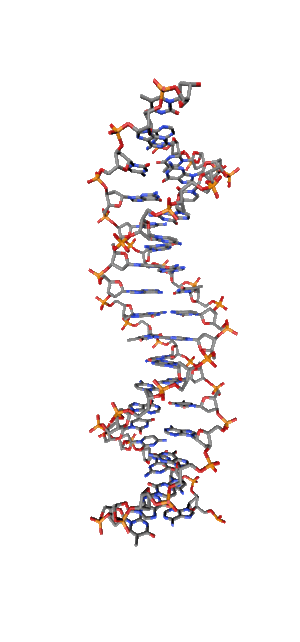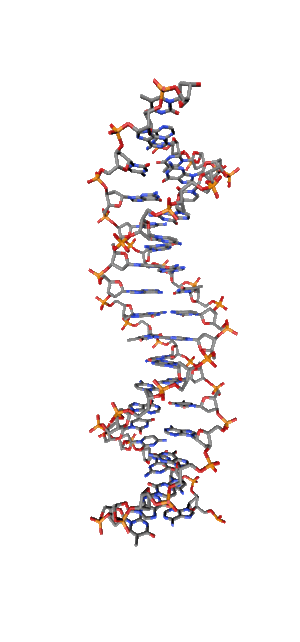
Рис. 1. Схематическая структура двойной спирали ДНК.
Так же как и в антеннах фотосистем, поглощение фотона в НК носит экситонный (когерентный) характер. Экситон в структуре упорядоченных хромофоров означает делокализацию, т.е. коллективное возбуждение, обеспечивающее транспорт энергии электронного возбуждения аналогично тому, как это имеет место в природных системах фотосинтеза. Спираль ДНК, как пример природной системы с π–π стэкинг взаимодействием, широко рассматривается как структура, в которой возможен эффективный перенос заряда [2,3] и энергии возбуждения [4]. Экситонный и зарядовый транспорт в НК имеет большое значение, прежде всего, для понимания механизмов и путей фотохимических реакций в ДНК [5,6], приводящих к фотохимическим повреждениям, мутагенезу и канцерогенезу [7,8]. Прямое поглощение ДНК UVB фотонов в спектральном диапазоне 290-320 нм солнечного излучения вблизи поверхности земли отвечает за формирование циклобутановых пиримидиновых димеров (CPD), вызывающих рак кожи.
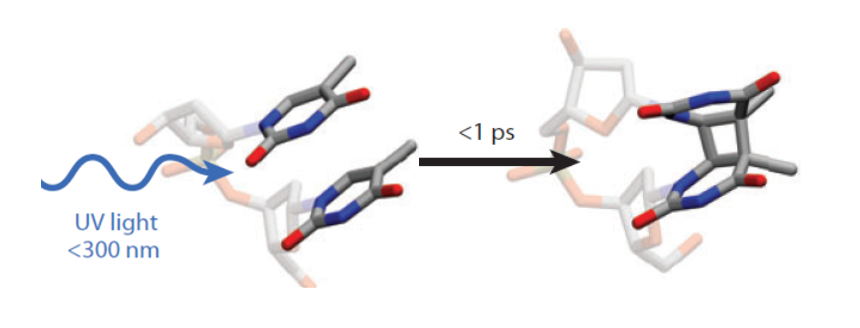
Рис. 2. Образование CPD димера в спирали ДНК за время меньшее 1 пс после поглощения фотона (адаптировано из [4]).
Некоторые конформации найденые в искривленных структурах ДНК обнаруживают значительное красное смещение длинноволновых электронных переходов экситонной природы, что увеличивает эффективность поглощения солнечного УФ излучения в таких структурах, интенсивность которого становится существенным в области >290 нм, где поглощение канонических форм ДНК резко падает. Мы показали, что такие структуры могут являться так называемыми горячими точками (hot spots) для фотохимических реакций в ДНК (R. R. Ramazanov, D. A. Maksimov, A. I. Kononov. Noncanonical Stacking Geometries of Nucleobases as a Preferred Target for Solar Radiation. J. Am. Chem. Soc. 2015, 137 (36), 11656–11665. [DOI link]).
Мы изучаем фотопоцессы, происходящие в ДНК в результате взаимодействия клетки с УФ солнечным излучением. Например, на этом рисунке показаны процессы, происходящие в структуре i-мотива ДНК:
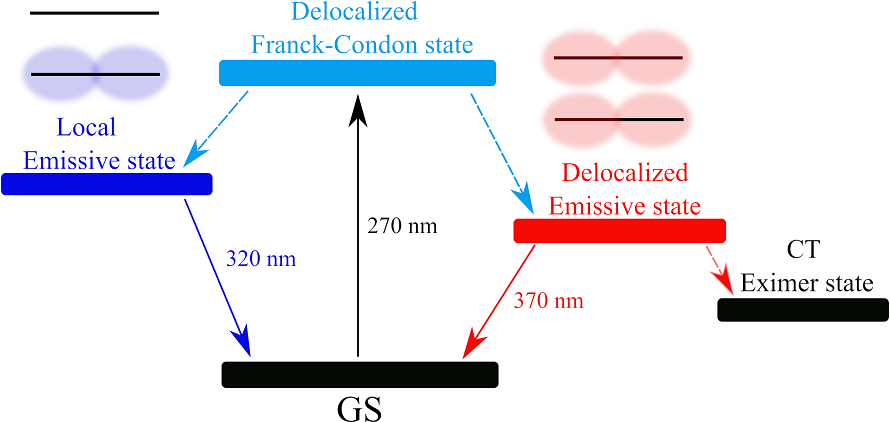
Возбужденные состояния и наиболее быстрые фотопроцессы в i-мотиве ДНК (Z. V. Reveguk, E. V. Khoroshilov, A. V. Sharkov, V. A. Pomogaev, A. A. Buglak, A. N. Tarnovsky, A. I. Kononov, Exciton Absorption and Luminescence in i-Motif DNA, Sci. Rep. 2019; 9: 15988. [DOI link]).
Мы изучаем также процессы и механизмы миграции энергии в комплексах ДНК с различными акцепторами. Например, кластер серебра может выступать в качестве десенсибилизатора, который локализует энергию УФ-возбуждения. Быстрая передача энергии от сегмента ДНК на кластер (рис. 3) может нейтрализовать негативное воздействие УФ-излучения и защитить ДНК и клетку от канцерогенного воздействия УФ-облучения.
 |
Рис. 3. Обложка журнала Nucleic Acids Research с картинкой из нашей статьи. Cover: DNA works as antenna transferring excitation energy to metal cluster.For more information see article I. L. Volkov, Z. V. Reveguk, P. Yu. Serdobintsev, R. R. Ramazanov, A. I. Kononov. DNA as UV light–harvesting antenna, Nucleic Acids Res., 2018, 46 (7), 3543-3551. [DOI link] ON COVER |
- M. Arndt, T. Juffmann, and V. Vedral, Quantum physics meets biology. HFSP Journal Vol. 3, No. 6, December 2009, 386–400.
- Slinker, J. D., Muren, N. B., Renfrew, S. E. & Barton, J. K. DNA charge transport over 34 nm. Nat Chem 3, 228-233, (2011).
- Livshits, G. I. et al. Long-range charge transport in single G-quadruplex DNA molecules. Nat Nano advance online publication, (2014).
- Middleton, C. T., de La Harpe, K., Su, C., Law, Y. K., Crespo-Hernández, C. E. & Kohler, B. DNA Excited-state dynamics: from single bases to the double helix. Annu. Rev. Phys.Chem. 60, 217-239, (2009).
- Cadet, J., Mouret, S., Ravanat, J.-L. & Douki, T. Photoinduced damage to cellular DNA: direct and photosensitized reactions. Photochem. Photobiol. 88, 1048-1065, (2012).
- Wurtmann, E. J.; Wolin, S. L. Crit. Rev. Biochem. Mol. Biol. 2009, 44, 34.
- de Gruijl, F. R. Skin cancer and solar UV radiation. Eur. J. Cancer 35, 2003-2009, (1999).
- Pfeifer, G. P., You, Y.-H. & Besaratinia, A. Mutations induced by ultraviolet light. Mutat. Res., Fundam. Mol. Mech. Mutagen. 571, 19-31, (2005).
- Brash, D. E. & Haseltine, W. A. UV-induced mutation hotspots occur at DNA damage hotspots. Nature 298, 189-192, (1982).
- Baverstock, K. F. & Cundall, R. B. Solitons and energy transfer in DNA. Nature 332, 312-313, (1988).

 Russian (Russia)
Russian (Russia)  English (United Kingdom)
English (United Kingdom)