Фотобиология и фотофизика биомолекул
Жизнедеятельность живых систем в условиях солнечной радиации обуславливает громадный интерес к фотонике биологических молекул. Природой в процессе эволюции были созданы уникальные молекулярные системы, эффективно взаимодействующие с солнечным излучением, такие как, например, сетчатка глаза животных, светособирающая антенна фотосинтетических реакционных центров растений и бактерий, в которых функциональными молекулами являются поглощающие свет пигменты. Понимание физики квантовых процессов взаимодействия света с биомолекулами и лекарственными веществами чрезвычайно важно не только с академической, но и с практической точки зрения, как для современной биомедицины, так и для быстро развивающейся отрасли биоинспирированного материаловедения.
Фотодинамическая терапия основана на разрушении клеток опухолей высокореактивными веществами (например синглетным кислородом), генерируемыми в тканях фотосенсибилизаторами (Рис. 1).
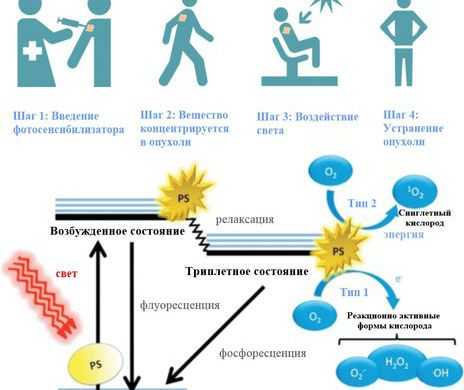
Рис. 1. Принцип фотодинамической терапии (источник).
Фотохимия и фотофизика сенсибилизаторов (соединения, генерирующие синглетный кислород (1О2) и применяемые в фотодинамической терапии (ФДТ) рака) исследована достаточно подробно и продолжает изучаться в настоящий момент во многих лабораториях мира. Вероятно, в ближайшие годы фотосенсибилизаторы станут еще более востребованы: из-за роста устойчивости бактерий к антибиотикам сенсибилизаторы будут повсеместно использоваться в антимикробной ФДТ [Wainwright et al, 2017].
Метод количественных соотношений структура-свойство (QSPR) применяется в фотохимии для предсказания длины волны максимума поглощения [Chaudret et al., 2015], интенсивности флюоресценции [Riahi et al., 2009], фотоиндуцированной токсичности, константы скорости фотолиза и квантового выхода фотолиза [Zhang, 2013]. До настоящего времени попыток применения QSPR для прогнозирования квантового выхода (КВ) генерации 1О2 не предпринималось. В этой связи наши исследования с применением методов вычислительной химии, QSPR и машинного обучения в фотохимии можно считать пионерскими, поскольку ранее подобного никто не делал. In silico модели позволяют предсказать будет ли разрабатываемое соединение обладать высоким КВ и стоит ли тратить время и ресурсы на его синтез. В этой связи с применением QSPR мы исследовали генерацию 1О2 птеринами и флавинами [Buglak et al, 2016], псораленами и ангелицинами [Buglak, Kononov, 2018], порфиринами и металлопорфиринами [Buglak et al, 2020], бор-дипиррометанами (BODIPY) [Buglak et al, 2021] (рис. 2).
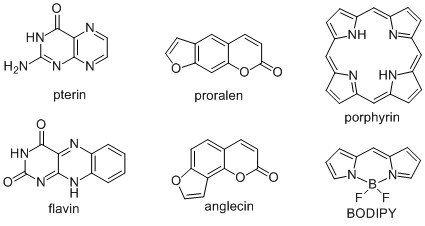
Рис. 2. Химические формулы основных исследованных соединений.
QSPR анализ проводили, используя различные методы машинного обучения: множественную линейную регрессию (multiple linear regression, MLR), метод опорных векторов (support vector machine, SVM) и случайный лес (random forest, RF). Мы показали, что QSPR применим для прогнозирования активности потенциально фотоактивных лекарственных соединений, обладающих клинической значимостью (рис. 3). В целом мы ожидаем, что разрабатываемый нами подход должен начать приносить пользу и применяться в фотомедицине в ближайшие годы.
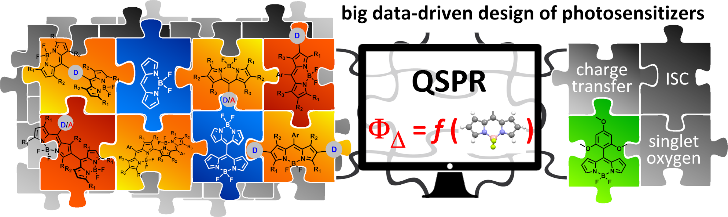
Рис. 3. Использование Big Data для дизайна BODIPY фотосенсибилизаторов (источник).
Экспериментально и теоретически мы планируем исследования на разработку новых сенсибилизаторов на основе кластеров металлов и углеродных квантовых точек.
Кроме того, в лаборатории ведутся и другие работы по изучению фотохимии биомолекул. Так, методами квантовой химии исследованы фотофизические свойства важного биологического кофермента – тетрагидробиоптерина (Н4Бип). В последние годы было показано, что Н4Бип может играть роль фоторецепторной молекулы в растениях и цианобактериях. Наши расчеты продемонстрировали возможность сверхбыстрой внутренней конверсии энергии фотовозбуждения Н4Бип. Также оценена возможность участия Н4Бип как электрон-донора в фотоиндуцированном переносе электрона (PET) [Buglak, Telegina, 2018]. С помощью теории функционала электронной плотности (DFT) оценена возможность протекания редокc-фотореакций между птеринами и молекулярным кислородом [Buglak et al, 2019], что важно с точки зрения применение данных соединений в ФДТ.
- Wainwright M, Maisch T, Nonell S, Plaetzer K, Almeida A, Tegos GP, Hamblin MR. Photoantimicrobials-are we afraid of the light? Lancet Infect Dis. 2017;17:e49-e55.
- Chaudret R, Kiss CsF, Subramanian L. Prediction of absorption wavelengths using a combination of semi-empirical quantum mechanics simulations and quantitative structure–property relationship modeling approaches. J Photochem Photobiol A. 2015;299:183-188.
- Riahi S, Beheshti A, Ganjali MR, Norouzi P. Quantum chemical calculations to reveal the relationship between the chemical structure and the fluorescence characteristics of phenylquinolinylethynes and phenylisoquinolinylethynes derivatives, and to predict their relative fluorescence intensity. Spectrochim Acta A. 2009:74(5):1077-1083.
- Buglak AA, Telegina TA, Kritsky MS. A quantitative structure-property relationship (QSPR) study of singlet oxygen generation by pteridines. Photochem Photobiol Sci. 2016;15:801-811.
- Buglak AA, Kononov AI. Triplet state generation by furocoumarins revisited: a combined QSPR/DFT approach. New J Chem. 2018;42:14424-14432.
- Buglak AA, Filatov MA, Hussain MA, Sugimoto M. Singlet Oxygen Generation by Porphyrins and Metalloporphyrins Revisited: a Quantitative Structure-Property Relationship (QSPR) Study. J Photochem Photobiol A. 2020;403:112833.
- Buglak AA, Charisiadis A, Sheehan A, Kingsbury CJ, Senge MO, Filatov MA. Quantitative Structure–Property Relationship Modelling for the Prediction of Singlet Oxygen Generation by Heavy‐atom‐free BODIPY Photosensitizers. Chem Eur J. 2021.
- Buglak AA, Telegina TA. A Theoretical Study of 5,6,7,8-Tetrahydro-6-Hydroxymethylpterin: Insight into Intrinsic Photoreceptor Properties of 6-Substituted Tetrahydropterins. Photochem Photobiol Sci. 2019;18:516-523.
- Buglak AA, Telegina TA, Vorotelyak EA, Kononov AI. Theoretical study of photoreactions between oxidized pterins and molecular oxygen. J Photochem Photobiol A. 2019;372:254-259.

 Russian (Russia)
Russian (Russia)  English (United Kingdom)
English (United Kingdom)